胃癌治疗新突破:DDR1抑制剂的潜力与机制研究
 找药助理
找药助理
关键词: #健康资讯
 找药助理
找药助理
关键词: #健康资讯
近年来,胃癌(GC)的治疗研究取得了新的突破。中山大学曾乐立研究团队在《Advanced Science》期刊上发表了一篇题为“DDR1 Drives Malignant Progression of Gastric Cancer by Suppressing HIF-1α Ubiquitination and Degradation”的研究论文。研究发现,盘状蛋白结构域受体1(DDR1),作为一个重要的细胞外基质(ECM)受体,在胃癌进展中起到了关键作用。通过抑制缺氧诱导因子-1α(HIF-1α)的泛素化和降解,DDR1增强了其对血管生成的转录调控,并通过激活HIF-1α/Ras同源家族成员A(RhoA)/Rho相关蛋白激酶1(ROCK1)信号通路促进肌动蛋白骨架重组,从而增强了转移能力。研究表明,抑制DDR1的药物可以有效阻止患者源性异种移植(PDX)和类器官模型中胃癌的进展和血管生成。

背景知识
胃癌是全球癌症相关死亡的第二大原因,造成了每年约76.9万人的死亡。虽然早期胃癌可以通过手术切除治疗,五年生存率超过90%,但由于其分子和临床特征的高度异质性,晚期胃癌的预后较差,扩散到远处器官后,患者的生存率仅为10%以下。近年来,靶向治疗作为一种有前景的恶性肿瘤治疗方法,因其针对特定基因或蛋白质的高效性和副作用小的特点,受到了广泛关注。然而,胃癌特异性治疗靶点的缺乏限制了靶向治疗的应用。因此,寻找新的胃癌治疗靶点变得尤为重要。
细胞外基质(ECM)是一个由细胞外大分子和矿物质组成的复杂网络,在物理组织的维持以及细胞过程(如增殖、粘附、迁移、极性、分化和凋亡)中发挥关键作用。研究表明,胶原蛋白作为ECM的重要成分之一,通过ECM-细胞相互作用调节肿瘤细胞和基质的生物学特性。DDR1是跨膜受体酪氨酸激酶(RTK)家族的成员,作为胶原受体在ECM-细胞相互作用中起重要作用。DDR1介导的胶原诱导信号传导被发现与肿瘤的化疗耐药和免疫逃逸有关。在胃癌中,DDR1的高表达与较差的生存率相关,抑制DDR1可以延缓转移,表明DDR1在胃癌中的重要性。然而,DDR1在胃癌中作用的具体机制仍不完全清楚。
DDR1在胃癌进展中的作用
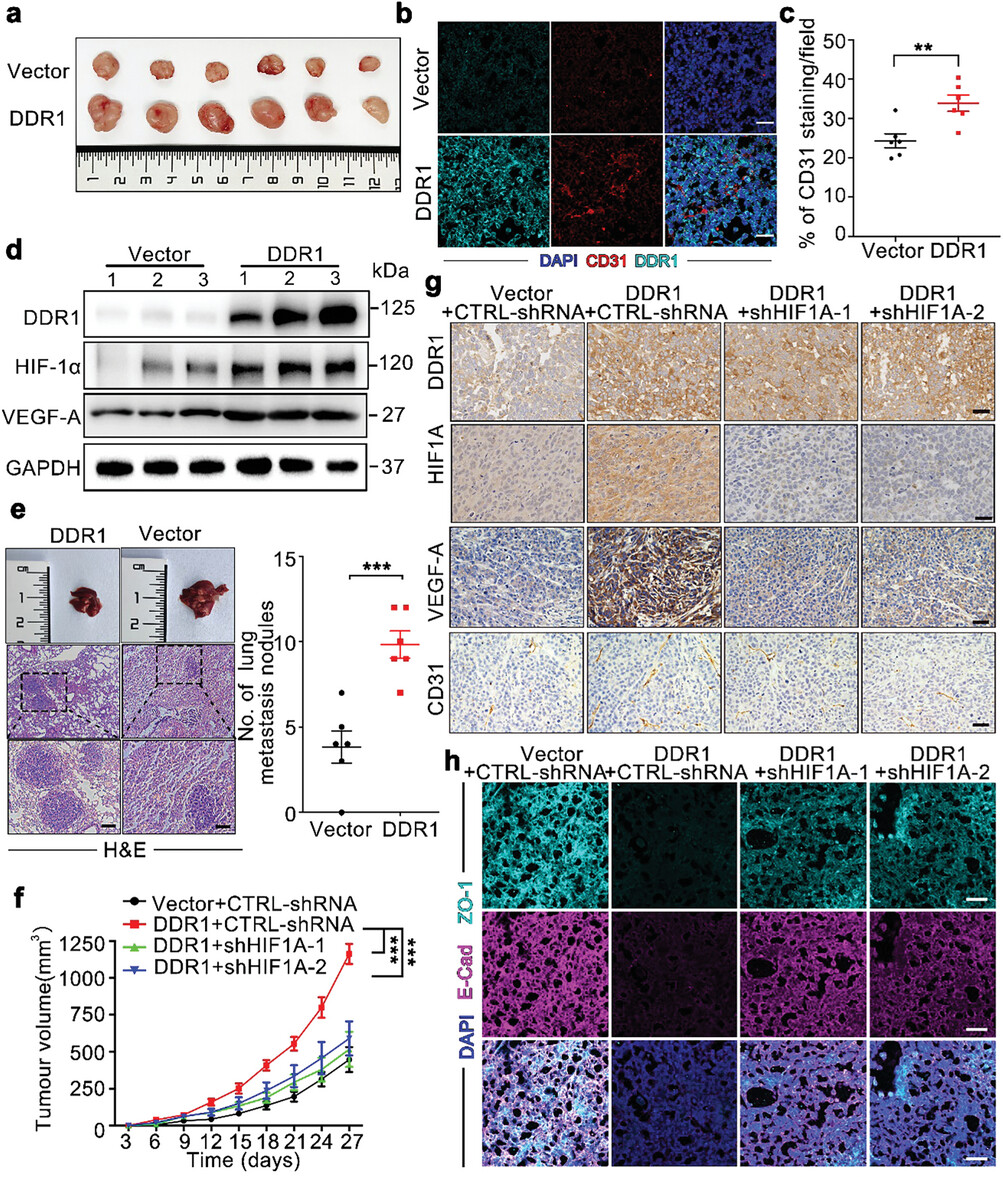
研究人员通过建立小鼠异种移植模型进一步探讨了DDR1对肿瘤进展的影响。通过皮下注射过表达和未过表达DDR1的AGS细胞,研究发现过表达DDR1的细胞形成的肿瘤体积和重量显著增加,并且微血管密度也显著提高。检测结果显示,过表达DDR1的移植瘤中HIF-1α和VEGF-A的表达水平较高,同时RhoA信号通路也上调,并促进了移植瘤的上皮-间质转化(EMT)过程。
通过尾静脉注射胃癌细胞建立肺转移模型,研究发现DDR1的过表达增加了肺微转移结节数量。此外,HIF-1α的表达被沉默后,DDR1诱导的血管生成和转移能力显著下降,提示HIF-1α是DDR1诱导胃癌血管生成和转移的重要介质。
DDR1抑制剂的治疗潜力
为了研究DDR1作为胃癌治疗靶点的潜力,研究人员在PDX和类器官模型中使用高选择性的DDR1抑制剂7rh苯甲酰胺来阻断DDR1信号通路。实验显示,7rh苯甲酰胺抑制DDR1能够显著降低PDX模型中HIF-1α和VEGF-A的表达水平,同时上调E-cadherin的表达。在类器官模型中,抑制DDR1也能阻止细胞骨架的重组,增强E-cadherin和ZO-1的表达。
研究总结
综上所述,本研究揭示了DDR1通过与HIF-1α直接相互作用,抑制其泛素化降解,从而促进胃癌恶性进展的机制。DDR1通过HIF-1α/RhoA/ROCK1信号通路促进细胞骨架重组和肿瘤转移。研究表明,药物抑制DDR1能够有效延缓PDX和类器官模型中胃癌的进展。研究结果表明,DDR1是一个有前景的胃癌治疗靶点,DDR1拮抗剂7rh苯甲酰胺作为胃癌患者的新型治疗选择展现出巨大潜力。

2025-04-16

2025-04-16

2025-04-16

2025-04-16

2025-04-16