内质网中多次跨膜蛋白结构生成途径的新发现
 找药助理
找药助理
关键词: #健康资讯
 找药助理
找药助理
关键词: #健康资讯
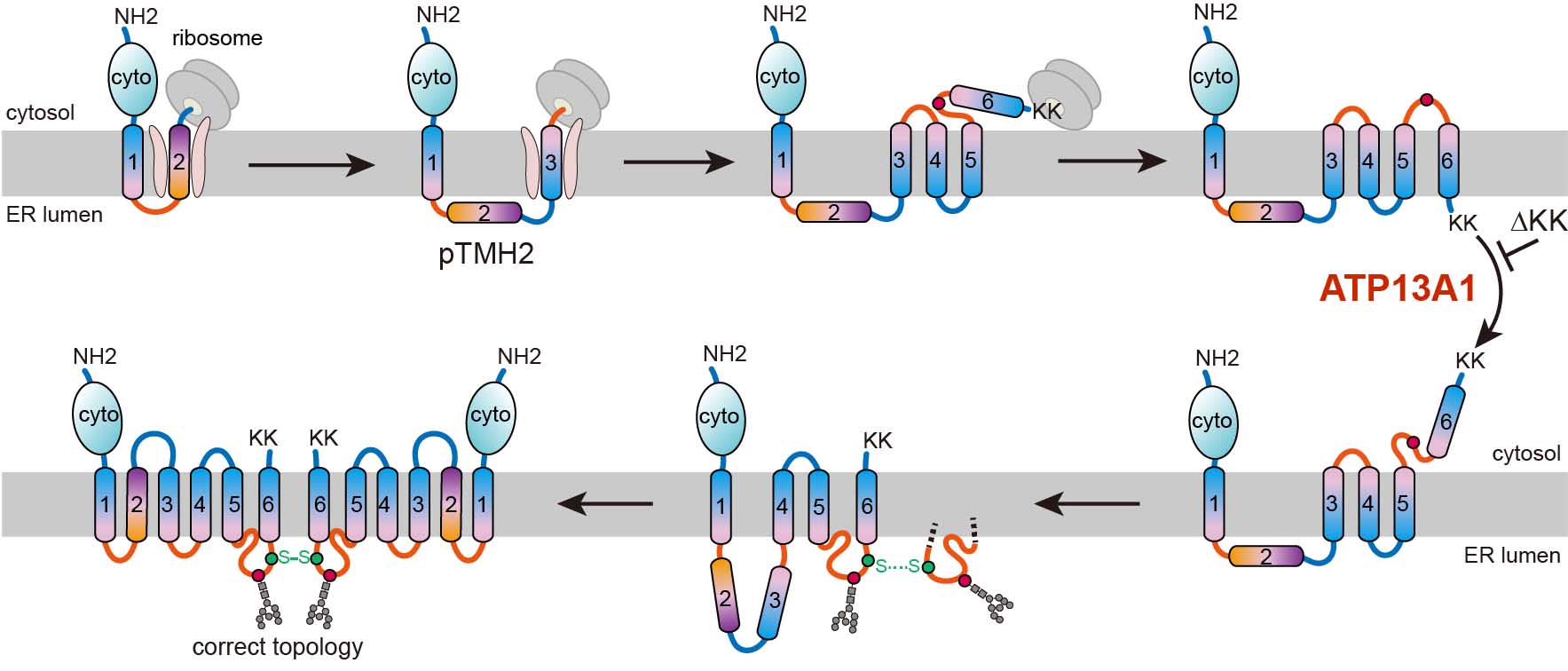
在人类细胞内的内质网膜上有大约5000种膜蛋白被合成,超过50%为多次跨膜蛋白。多次跨膜蛋白在细胞中扮演着离子通道、转运蛋白、受体蛋白、跨膜酶等重要角色。这些功能主要取决于跨膜结构域中的极性和带电氨基酸,而这些氨基酸侧链通常具有排斥脂质的性质,使得跨膜螺旋(TMH)的疏水性较低。统计数据显示,人类蛋白质组中约30%的膜蛋白和超过50%的多次跨膜蛋白包含至少一个极低疏水性的TMH(pTMH)。在多次跨膜蛋白的成熟结构中,pTMH通常被周围的TMH所保护,以避免直接接触磷脂双分子层的膜结构。然而,这些pTMH通常难以被转位子直接识别和插入。如何识别这些pTMH并克服磷脂环境的疏水性,将其包装进成熟的多次跨膜结构,这仍是一个相关领域尚未完全理解的科学问题。
最近,在上海有机化学研究所生物与化学交叉研究中心,张在荣团队在《分子细胞》期刊上发表了一篇题为《AnATP13A1辅助的多跨膜蛋白折叠途径》的研究论文,揭示了由pTMH引导的多次跨膜蛋白结构生成途径。新合成的pTMH不会立即插入内质网膜,而是通过移位子通道进入水溶性内质网腔,导致后续的TMHs以与最终结构相反的方向错误插入内质网膜。在合成完成后,P5-ATPaseATP13A1可以识别和矫正这些“错误”中间体结构,使停留在内质网腔中的pTMH能够被识别,被整合和折叠到几乎成熟的结构中,最终获得成熟的构象。
利用六次穿透细胞膜的ABC类转运蛋白ABCG2和人类细胞完成实验研究后,科研人员发现,ABCG2中新生的pTMH2能够穿越转位子直接到达内质网腔,导致下游TMHs错误地整合到膜中,形成中间体构型。在ABCG2的羧基端的双赖氨酸翻译结束后,其构型经历了近乎全局的拓扑重排。进一步研究表明,ATP13A1能够察觉这种双赖氨酸的正电信号,当这些双赖氨酸突变为负电或电中性氨基酸时,ATP13A1与ABCG2突变体的相互作用明显减弱。敲除ATP13A1会导致细胞内大量折叠中间体构型的ABCG2积累。ATP13A1在多次穿膜蛋白的拓扑结构成熟中发挥作用,促使ABCG2中的反向插入TMH6从磷脂双分子层中解离。细胞质中暴露的TMH6会以正确的方向重新插入内质网膜,推动上游TMHs在翻译后进行拓扑重排。
TMHs被错误定向后重新排列后,这种不成熟的中间体可能发生二聚化,形成四级结构,这可能有助于促进之后的pTMH2与其他跨膜螺旋的组装,使得pTMH2能够整合到膜层中,形成被其他TMHs所包围的最终结构。该研究揭示了关键的功能路径,即pTMH的拓扑生成途径是与脂质互斥的,表明pTMH可引导膜蛋白在翻译后进行拓扑结构的重排,从而避免pTMH在折叠时暴露在疏水磷脂环境中。
该研究项目得到了国家自然科学基金委员会、中国科学院以及上海市科技委员会的资助。

2025-12-14

2025-12-14

2025-12-14

2025-12-14

2025-12-14