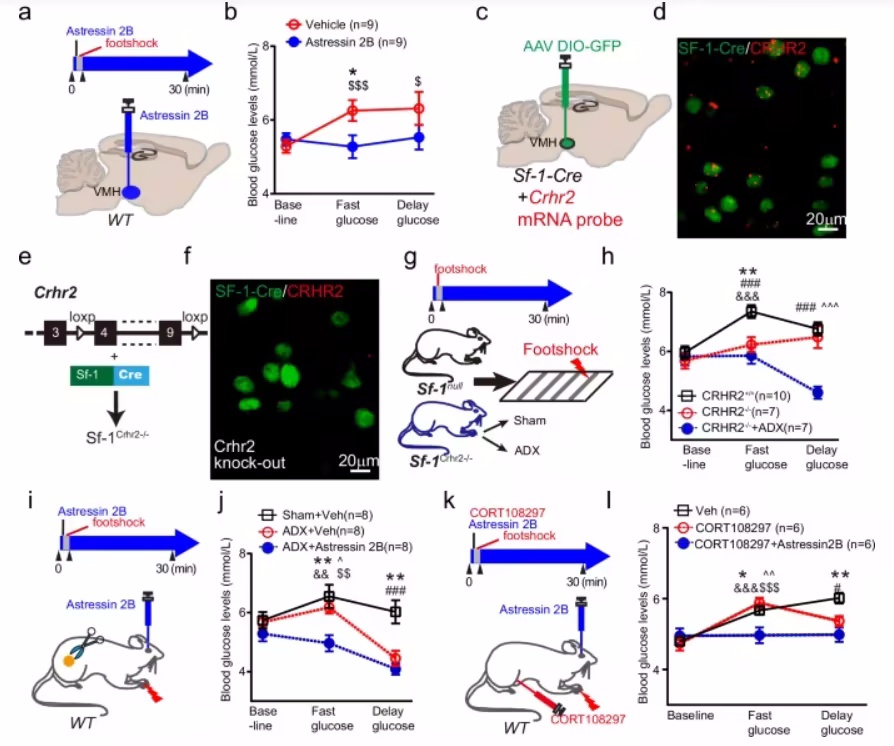
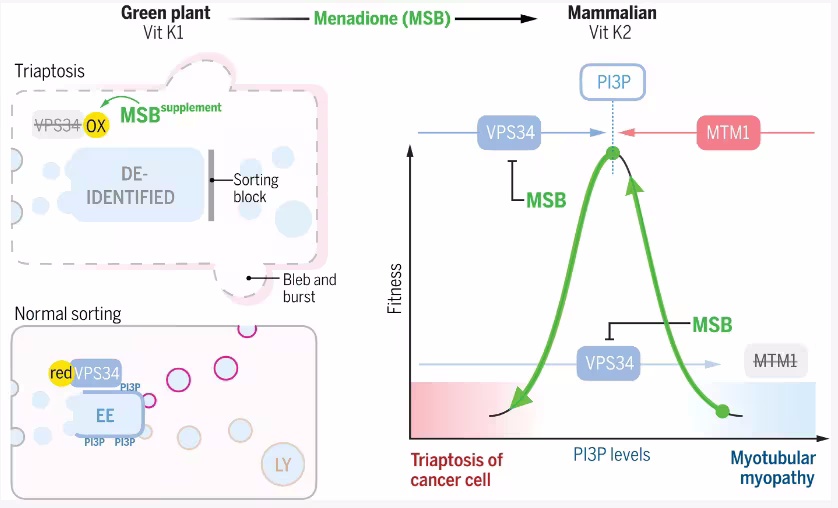
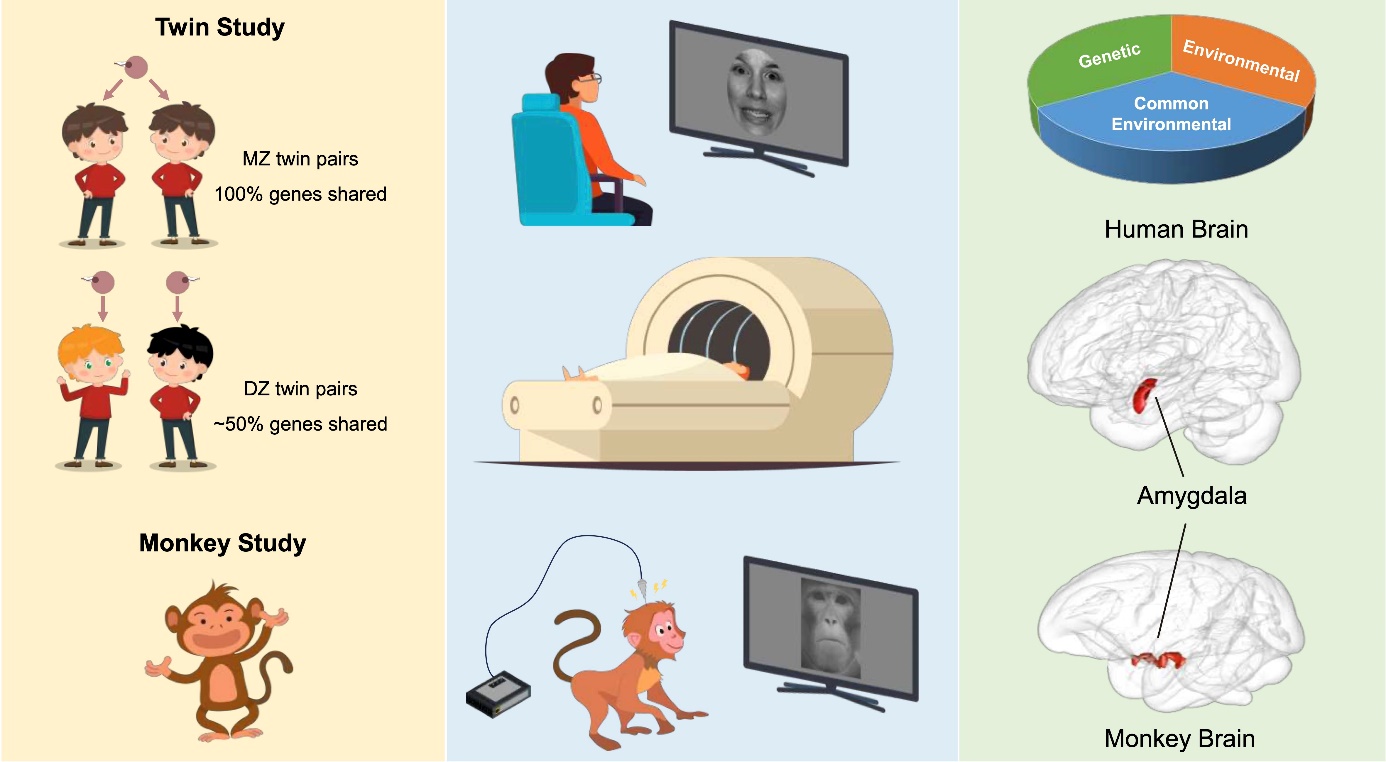
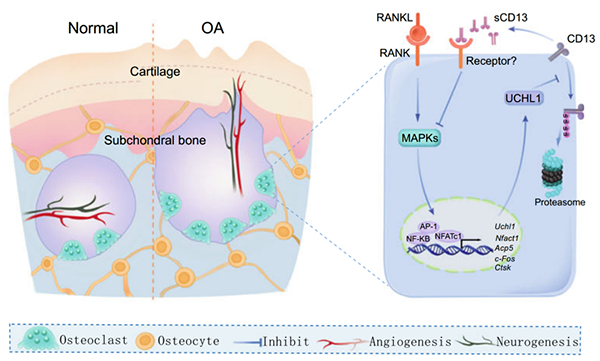
蛋白质作为生命活动的基础,其功能不仅依赖于自身的结构,还受到与其他蛋白质之间相互作用的深刻影响。蛋白质相互作用(Protein-Protein
Interaction,PPI)研究是现代生物学的一个重要领域,深入理解这些相互作用对于揭示细胞内的生物过程、疾病机制等方面具有至关重要的意义。交联质谱(Cross-Linking
Mass Spectrometry,XL-MS)作为一种新兴的技术,因其能够提供高分辨率的结构信息,在蛋白质相互作用的研究中发挥着越来越重要的作用。 交联质谱技术的基本原理与挑战 XL-MS技术基于共价交联原理,通过使用交联剂将空间上接近的蛋白质或蛋白质内部的氨基酸残基共价连接,产生交联信息。这些交联信息通过质谱检测后,可以揭示蛋白质复合物的三维结构。然而,尽管XL-MS技术在蛋白质相互作用研究中展现出巨大的潜力,但它在数据分析方面面临着一系列挑战。传统的XL-MS数据分析依赖于已知的蛋白质三维结构,这种方法容易低估假发现率(FDR),而且现有的XL-MS标准多基于较小规模的肽库,难以模拟复杂的真实蛋白质组实验。因此,开发更复杂、更具有代表性的标准数据集成为提高XL-MS技术应用价值的关键。 XL-MS标准的构建与应用 为了解决这些问题,研究人员开发了一种新型的大规模XL-MS标准,这一标准包含数百种重组蛋白质,经过系统混合和交联,生成了复杂的标准数据集。这些蛋白质被分为32个相互作用组,每组包含8种蛋白质,组内两两交联,最终形成896种独特的蛋白质相互作用。这种标准化的标准数据集具有高度的复杂性和真实性,为开发和验证XL-MS数据分析工具提供了宝贵的资源。 为了确保数据的可靠性和可重复性,研究人员对不同批次的数据集进行了多次实验验证,包括人工神经网络(ANN)模型的开发、液相色谱-质谱(LC-MS)方法的优化以及XL-MS搜索引擎的基准测试。这些措施确保了数据集的质量和一致性,使得XL-MS技术在蛋白质相互作用研究中的应用更加精准。 Scout:新一代XL-MS数据分析工具 基于这一新型XL-MS标准,研究人员开发了Scout,一款基于人工神经网络的XL-MS数据分析搜索引擎。Scout的设计充分利用了人工神经网络的优势,在数据处理的灵敏度、特异性和处理速度上表现出色。Scout通过多层次的假发现率(FDR)过滤,能够在交联谱匹配、残基对(ResPairs)以及蛋白质相互作用(PPI)各个层面保持高灵敏度和低假发现率,从而提高了数据分析的准确性。 与传统的XL-MS搜索引擎相比,Scout在处理大规模数据集时展现出明显的优势。例如,在处理一个包含4,000个蛋白质的大型数据库时,Scout在保持1%
FDR的前提下,成功识别出195个PPIs,覆盖率达到了43.5%。此外,Scout的处理速度也大幅度提升,在处理小型和大型数据库时,其速度较其他工具快200倍以上,使得XL-MS数据分析变得更加高效。 Scout与其他XL-MS搜索引擎的比较 为了验证Scout的性能,研究团队将其与其他多种主流XL-MS搜索引擎,如MaxLynx、MSAnnika、XlinkX
PD和MeroX等,进行了比较。实验结果显示,Scout在速度、灵敏度和FDR控制方面均表现出色。在数据的处理上,Scout显著降低了假发现率,并且能够在较短的时间内完成大规模数据的分析。 这些测试表明,Scout不仅在高特异性与高灵敏度之间取得了更好的平衡,而且其高效的计算速度使得其在大规模数据分析中具有更强的实用性和灵活性。无论是在基础研究还是在临床研究中,Scout都能够提供更为可靠和准确的蛋白质相互作用数据。 XL-MS技术的未来发展 随着质谱技术和交联试剂的不断进步,XL-MS的应用范围也在不断扩展。除了传统的蛋白质相互作用研究,XL-MS还可以广泛应用于药物与蛋白质的相互作用、跨膜蛋白的结构解析等领域。通过与其他蛋白质组学技术(如冷冻电子显微镜、核磁共振)结合,XL-MS有望为研究人员提供更全面、更精细的蛋白质相互作用数据。 未来,随着人工智能和机器学习算法在XL-MS数据分析中的不断应用,数据处理的速度和准确性将进一步提升。Scout作为一款基于人工神经网络的工具,其后续版本可能会引入更为先进的深度学习模型,从而在复杂生物样本的分析中展现出更强的能力。XL-MS技术与Scout的结合为蛋白质相互作用研究提供了一个崭新的视角,推动了生物医学研究向更高精度、更高效率的方向发展。 结语 交联质谱技术,尤其是在Scout等新型数据分析工具的推动下,已经成为蛋白质相互作用研究中不可或缺的重要手段。通过提供亚纳米级的分辨率,XL-MS技术使得研究人员能够在更高空间和时间分辨率下研究蛋白质之间的相互作用。随着技术的不断进步,未来XL-MS有望在更复杂的生物体系中得到广泛应用,推动生物学研究和疾病治疗的进步。