肥胖是现代社会面临的一个重大健康问题,其成因复杂,涉及遗传、饮食习惯、生活方式及多种环境因素。近期,来自密歇根大学医学院的科学家们通过一项研究揭示了肥胖相关基因SH2B1对大脑功能的分子影响机制,为我们理解肥胖的成因提供了新的视角。这项研究发表在国际杂志《Advanced
Science》上,题为“SH2B1 Defends Against Energy Imbalance, Obesity, and Metabolic
Disease via a Paraventricular Hypothalamus→Dorsal Raphe Nucleus
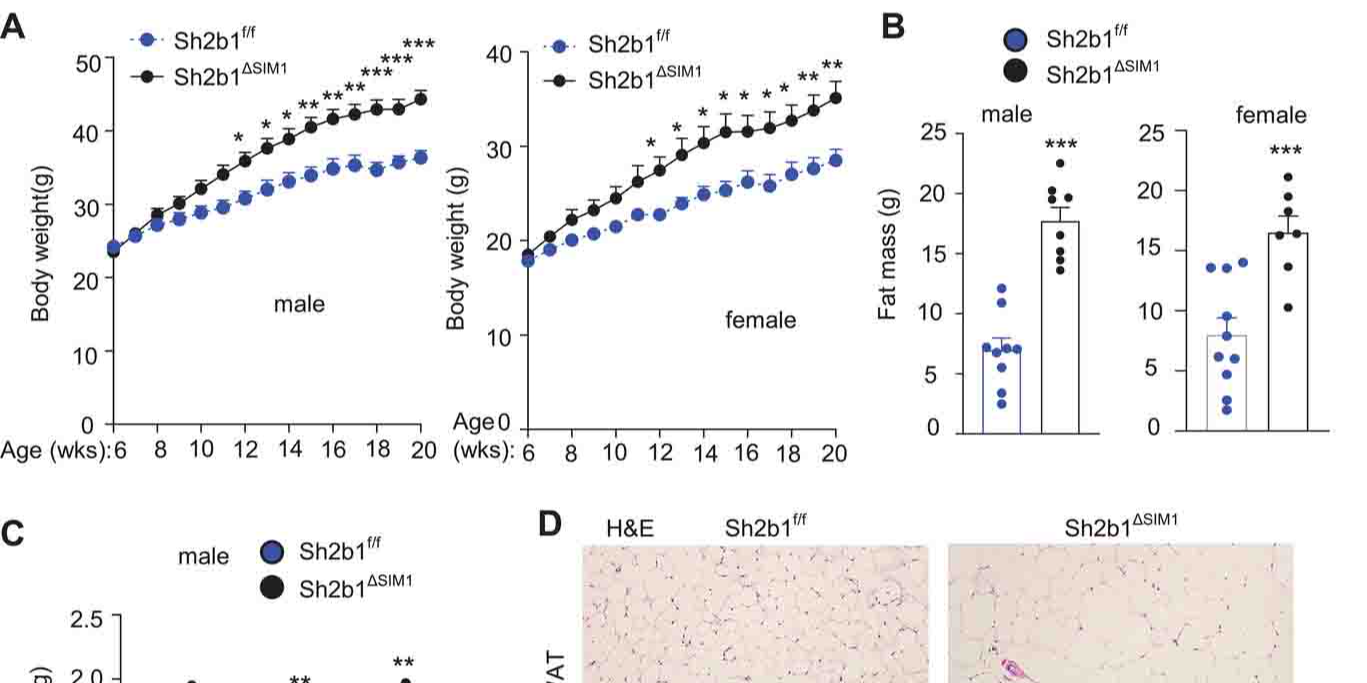
Neurocircuit”。 SH2B1基因的作用与研究发现 SH2B1基因在调控饮食摄入和能量平衡方面扮演着关键角色。该基因的变异常与肥胖、2型糖尿病以及脂肪性肝脏疾病(以前称为非酒精性脂肪性肝病)等代谢功能障碍紧密相关。SH2B1基因精细调控人体的食欲与能量消耗,肥胖的发生源自两大对立过程的失衡:过量饮食与能量消耗不足。 研究人员定位了SH2B1基因在大脑中的活动区域——下丘脑室旁核(PVH)。PVH作为大脑的一个中枢区域,主要负责血压与体液平衡的调控。进一步的研究发现,表达SH2B1的神经元构成了一条神经环路,与脑干中的背侧中缝核(DRN)相互作用。DRN区域与能量平衡、体重控制及情绪驱动的行为息息相关。刺激这条特定的神经环路能有效抑制小鼠的饥饿感,反之,抑制PVH中SH2B1表达的神经元则会导致肥胖。 SH2B1与BDNF/TrkB信号传导 此外,研究还阐明了SH2B1如何通过加强脑源性神经营养因子(BDNF)/TrkB信号传导帮助维持体重稳定。BDNF/TrkB信号在发育期促进大脑成长,成年后则维护大脑健康。一旦该信号通路出现故障,就会导致肥胖及代谢性相关疾病。研究者提出,有理论认为,与体重增加相关的炎症可能间接干扰这一信号通路,削弱了停止进食的生理信号。鉴于SH2B1在从昆虫到人类的广泛物种中高度保守,它如同“通用货币”,在细胞信号增强、瘦素与胰岛素分泌促进等方面发挥着核心作用,对食欲及新陈代谢的调控至关重要。 临床应用与未来研究方向 值得注意的是,目前尚未发现增强SH2B1蛋白活性的副作用,这与某些流行药物如索马鲁肽(Ozempic)和替西帕肽降糖版(Mounjaro)激活GLP-1受体的方式有所不同。若能找到方法增强SH2B1的活性,或将为肥胖及其相关疾病的治疗带来新的希望。 研究的意义与展望 总的来说,这项研究揭示了一个此前未被认知的PVH-SH2B1→DRN神经环路,其中SH2B1通过强化BDNF/TrkB信号传导,构筑起一道抵御肥胖的防线,为肥胖症的防治提供了崭新的理论依据与潜在靶点。这一发现不仅拓宽了我们对肥胖成因的理解,也为未来开发新的治疗策略提供了重要参考。 未来,科学家们将继续深入研究SH2B1基因及其相关的分子机制,探索更多可能的治疗途径。通过进一步的实验和临床试验,或许能够找到更加有效的方法来调控SH2B1的活性,从而为肥胖及其相关疾病的防治带来突破性进展。 结语 肥胖问题的复杂性不仅在于其多重因素的影响,更在于其对健康的广泛危害。理解基因在肥胖发生中的作用,将有助于我们开发更精准和有效的治疗方法。密歇根大学医学院的这项研究为我们揭示了肥胖基因SH2B1在大脑中的关键作用,并提供了新的治疗思路。未来,通过进一步的研究和临床应用,我们有望找到更有效的方法来应对这一全球性健康挑战。