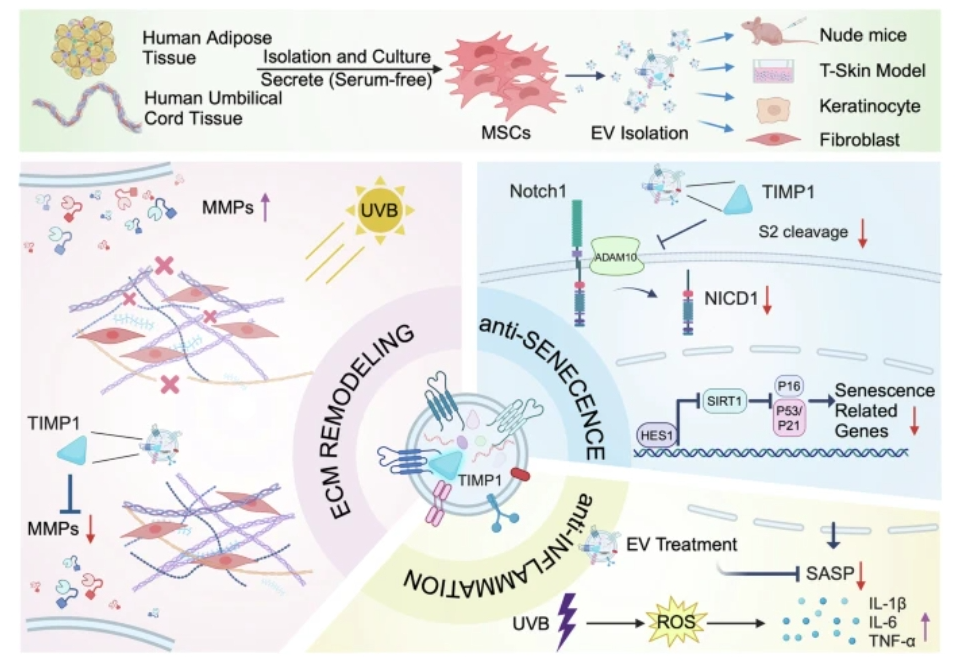
2024年10月28日,中国科学院微生物研究所尹文兵团队与北京大学定量生物学中心罗春雄团队合作,在《Advanced
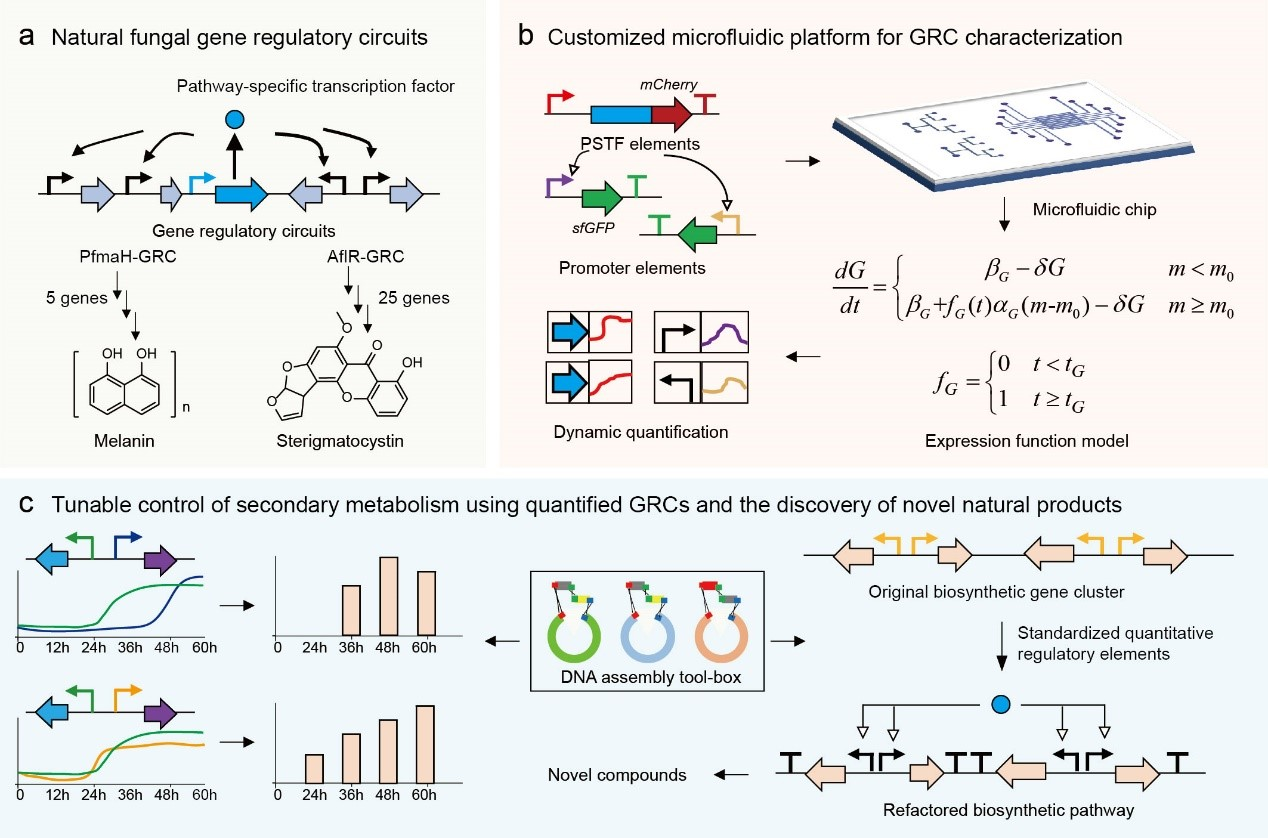
Science》期刊上发表了一篇名为“定量表征与真菌次生代谢相关的基因调控电路以发现新型天然产物”的研究论文。这项研究提出了一种具有高精度的丝状真菌调控基因的定量表征与应用方法,为天然产物的发现和生产提供了新的工具和思路。 丝状真菌的潜力与挑战 丝状真菌,作为一类重要的真菌,广泛用于生物制药和食品工业,尤其在抗生素如青霉素的生产中发挥了重要作用。尽管其在代谢产物合成方面显示出巨大的潜力,但对丝状真菌的合成生物学系统的深入研究仍然相对薄弱。目前,关于其代谢产物的精确控制和调节机制的理解仍处于起步阶段。如何更好地利用丝状真菌合成生物学,特别是在天然产物的发现和生产中,成为了科学家们亟待解决的问题。 新的定量表征方法 本研究的核心是开发了一种新颖的定量表征方法,利用微流控平台、数学模型整合以及多细胞丝状真菌的单细胞化控制,克服了传统基因表达定量面临的挑战。该方法使得研究人员能够动态、准确地表征真菌代谢产物的关键基因调控回路(gene
regulatory circuits, GRC)。 在研究中,尹文兵团队与罗春雄团队通过将不同的微流控单元与数学模型结合,成功实现了对丝状真菌如柄曲霉的代谢过程的实时监测。这一创新不仅提高了对代谢产物合成的理解,还为高效生产药物和其他重要化合物提供了新路径。 应用示例与成果 研究人员将这一方法应用于免疫抑制剂霉酚酸(mycophenolic
acid)和杀虫剂白僵菌素(beauvericin)的生产,取得了良好的效果。此外,通过定量表征的元件,研究小组成功重构了超过10个合成基因的多硫代二酮哌嗪类化合物的基因簇,获得了新颖的天然产物。这一发现表明,新的定量表征方法不仅具有科学研究价值,同时也为天然产物的高效合成奠定了基础。 研究的影响与前景 本研究的成功为丝状真菌的合成生物学研究提供了新的思路,尤其是在代谢工程和天然产物发现领域。通过量化基因调控回路,研究人员能够更深入地理解真菌代谢过程中的关键调控机制,这将有助于设计和优化天然产物的合成路径。 未来,这种方法的推广应用不仅能够加速天然产物的发现,还可以为制药工业提供新的生产平台,尤其是在开发新药和改进现有药物的过程中,具备重要的应用价值。此外,随着合成生物学的不断发展,该方法也可能被应用于其他微生物的研究,为微生物的代谢调控提供新的解决方案。 结论 综上所述,中国科学院微生物研究所和北京大学的研究团队通过开发一种高效的定量表征方法,成功克服了丝状真菌基因表达定量的难题,为天然产物的发现和生产开辟了新的道路。这项研究不仅为科学界提供了新的工具和思路,同时也为制药和生物产业的创新发展注入了新活力。随着未来进一步的研究和应用,这种方法有望在更广泛的领域中发挥作用,为人类健康和环境保护做出更大贡献。