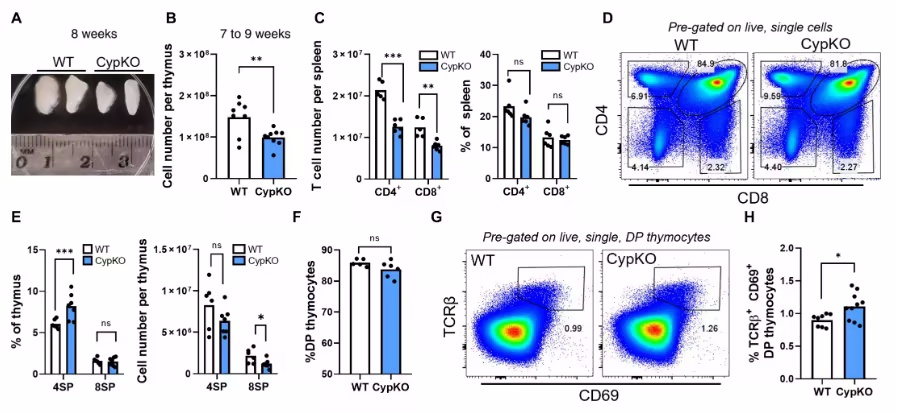
肉瘤是一类较为罕见且异质性强的间质肿瘤,主要发生在骨骼和软组织中,尤其对年轻患者造成严重影响。在美国,每年约有13,000例软组织肉瘤和4,000例骨肉瘤的诊断,尽管发病率不高,但相关的死亡率依然较高。特别是,骨肉瘤已成为20岁以下患者癌症死亡的第三大原因。治疗方案的选择通常依赖于疾病的亚型和分期,包括手术切除、化疗、靶向全身治疗以及某些情况下的放射治疗。虽然在一些特定亚型上取得了进展,但目前的治疗方式往往难以治愈,软组织肉瘤的总体5年生存率为65%,而骨癌则为50%至60%。 肉瘤的异质性表现在其存在超过100种不同的亚型。以骨肉瘤为例,已有报告指出存在9种不同的亚型。大约25%的肉瘤病例由特定的染色体融合引起,如尤文氏肉瘤、滑膜肉瘤、婴儿纤维肉瘤和横纹肌肉瘤等。此外,其他类型的骨和软组织肉瘤的遗传诱因还包括影响细胞周期调节、成长因子信号传导及血管生成的因素。特异性高的致病突变包括上皮样肉瘤中的RTK驱动突变、脂肪肉瘤中的CDK异常、以及血管周细胞瘤和黏液样脂肪肉瘤中的PI3K突变等。某些肿瘤如骨肉瘤和未分化肉瘤则表现出复杂的核型,可能携带多种突变,并没有单一的明确驱动因素。这种广泛的遗传异质性给确定有效的治疗方案带来了挑战,导致肉瘤患者的生存率持续低迷。 近年来,精准医学逐渐受到重视,成为识别可操作性特征并改善患者预后的重要工具。新一代测序(NGS)和免疫组织化学等技术被广泛应用于患者分子水平变化的识别和药物靶点的发现。然而,在融合阳性肉瘤的情况下,除了NTRK,其他大多数异常癌基因难以直接靶向干预。最新研究显示,在对6,000多例骨和软组织肉瘤的调查中,约42%的肿瘤含有可干预的突变。然而,尽管过去10年的多项临床试验中,肉瘤患者在使用基因组精准医学选择的药物时显示出的临床益处却相对有限。这一遗传多样性以及传统或精准医学选择的化疗和靶向药物疗效的局限,促使研究者急需寻找新的方法系统评估肉瘤的药物敏感性与耐药性,并制定个性化的治疗方案。 近日,加州大学洛杉矶分校的Alice
Soragni研究小组在《细胞干细胞》期刊上发表了题为《肉瘤的药物敏感性和耐药性景观》的研究文章,基于患者来源的肿瘤类器官(PDTOs),探讨了21种肉瘤类型的药物敏感性与耐药性。他们从126例患者中获取了194个样本,并成功生成了121个样本的PDTOs,覆盖24种不同肉瘤亚型。 PDTOs可以模拟多种恶性肿瘤的行为特征,特别是在上皮癌患者中,PDTOs的可操作性和对药物反应的预测能力表现优异。然而,肉瘤的PDTOs发展较慢,应用相对有限。研究小组利用PDTOs表征肉瘤的耐药性与敏感性,结合高通量类器官筛选平台和组织病理学检测,评估了类器官对单一药物及联合药物的敏感性与耐药性,并在手术后一周内获得结果。研究表明,药物的敏感性与肿瘤亚型、治疗历史及疾病进展等临床特征密切相关。 通过PDTO筛查,研究者能够为患者提供最佳的药物选择,并反映出肉瘤患者的预后情况。在他们的工作中,为59%的样本所对应的患者确定了至少一种已获FDA批准或NCCN推荐的有效治疗方案,显示出PDTOs平台的临床应用潜力。 总之,作者通过PDTOs在24种肉瘤类型中研究药物敏感性和耐药性模式,发现患者的亚型特异性反应与临床特征和预后之间存在关联。这一研究不仅为大多数样本对应患者确定了可操作的治疗方案,还突显了类器官在精准医学应用中的巨大潜力,为未来个性化治疗策略的制定提供了新思路。