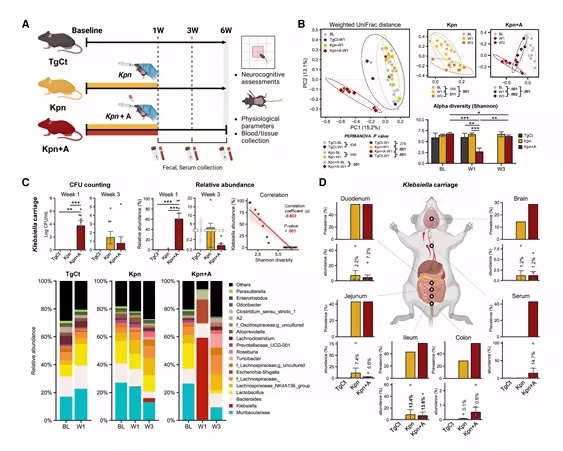
肺炎克雷伯菌(Klebsiella
pneumoniae)是常见的医院获得性感染致病菌之一,通常与败血症、肺炎等严重疾病相关。然而,近来研究表明,肺炎克雷伯菌不仅能引起肠道和全身的感染,还可能与阿尔兹海默病(Alzheimer's
disease, AD)等神经退行性疾病的发生和发展密切相关。近期,发表在《The Journal of Infectious
Diseases》上的一项研究进一步揭示了肠道菌群失调如何通过肺炎克雷伯菌的感染,推动神经性炎症和认知功能损伤,且这一过程可能为阿尔兹海默病的加重提供新的机制视角。 肠道菌群失调与神经性炎症的关系 近年来的研究表明,肠道菌群对宿主的免疫反应、代谢功能以及神经系统健康有着重要的调节作用。研究者们提出的“肠脑轴”理论表明,肠道和大脑之间通过神经、免疫以及内分泌途径相互联系。肠道菌群的失调可以通过这些途径影响大脑的功能,甚至引发或加剧神经退行性疾病。 在这项研究中,来自佛罗里达州立大学的研究人员发现,肺炎克雷伯菌可以通过肠道进入血液,再通过血脑屏障进入大脑,导致大脑中的神经性炎症反应。这种炎症反应会损伤大脑的认知功能,表现出类似于阿尔兹海默病的症状。这一发现揭示了肠道菌群在感染和神经退行性疾病发展中的关键作用,并可能为新型的阿尔兹海默病治疗策略提供重要的理论依据。 肠道功能破坏与感染扩散 研究还进一步揭示了抗生素在肠道菌群失调中的作用。当抗生素用于治疗感染时,虽然能有效清除病原菌,但也会破坏肠道内的微生物平衡,减少肠道菌群的多样性。研究表明,肠道菌群的失衡为某些有害菌种,如肺炎克雷伯菌的增殖提供了有利环境。这些有害细菌通过肠壁进入血液后,最终可通过血液循环进入大脑,引发神经性炎症。 这一过程不仅加剧了肠道问题,还影响了大脑的健康,进一步导致认知障碍的出现。研究人员指出,抗生素疗法的使用虽然有助于控制感染,但其可能对老年人的肠道健康造成负面影响,增加其神经性炎症和认知功能障碍的风险。 肺炎克雷伯菌感染与阿尔兹海默病 肺炎克雷伯菌作为一种常见的医院获得性感染因子,其通过肠脑轴的作用在神经退行性疾病中的潜在影响令人关注。研究者指出,肺炎克雷伯菌的感染不仅仅是对局部器官的危害,还可能通过诱发系统性炎症,促进神经变性和认知功能的衰退。 在这项研究中,研究人员使用3xTg-AD转基因小鼠模型来模拟阿尔兹海默病的进展,发现肺炎克雷伯菌感染能够显著加剧小鼠大脑中的炎症反应,损害其认知功能,进一步加速阿尔兹海默病的病理进展。研究者表示,这一发现揭示了肠道感染与阿尔兹海默病之间可能存在的直接联系,并提示感染性因子可能在阿尔兹海默病的病因学中扮演重要角色。 医院获得性感染对神经健康的潜在威胁 此次研究为医院获得性感染,尤其是败血症感染与阿尔兹海默病等神经性疾病之间的关系提供了新的见解。研究者Nagpal教授强调,医院获得性感染和败血症可能是老年人群中神经性炎症和认知功能障碍的重要风险因素,尤其是对于那些长期住院或经历过抗生素治疗的患者。肠道菌群的失衡,尤其是在抗生素疗法的影响下,可能加重这一风险。 此外,这项研究还提示了治疗阿尔兹海默病的新方向。研究人员认为,除了现有的针对淀粉样蛋白和tau蛋白的治疗策略外,未来可能需要开发创新性的治疗方法,针对感染性因子进行干预,尤其是在免疫受损的老年人群中。这将有助于降低医院获得性感染对神经系统的潜在威胁,并减缓或逆转认知功能的衰退。 未来的研究方向与临床意义 这项研究为理解感染性因子如何通过肠脑轴影响阿尔兹海默病的进展提供了新的理论支持。研究人员建议,未来的研究应进一步探索如何管理和预防医院获得性感染,以保持老年人群的认知健康。此外,开发能够维持或恢复肠道菌群平衡的干预措施,可能成为防治阿尔兹海默病的新途径。 总之,本研究不仅揭示了肺炎克雷伯菌感染与神经性炎症和认知损伤之间的联系,还突出了肠道菌群在阿尔兹海默病发病机制中的重要作用。这为未来的神经退行性疾病治疗提供了新的视角,并为感染性因素与神经性疾病之间的关系研究奠定了基础。