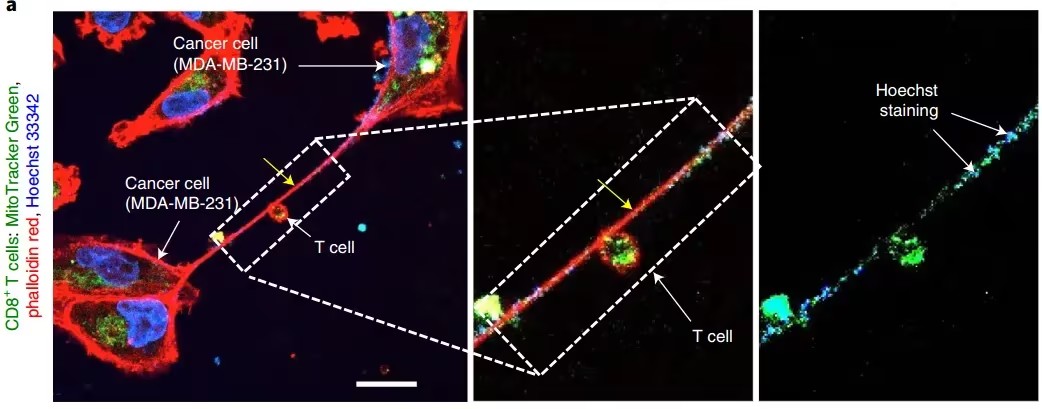
氯氮平是目前治疗难治性精神分裂症的主要药物之一,尤其是对于大约五分之一的精神分裂症患者而言,氮氯平是唯一能有效治疗精神分裂症的治疗方法。此外,氯氮平还能显着降低患者的自杀风险,是目前唯一被批准用于预防性精神分裂症患者自杀的药物。然而,尽管取得了成功,不良反应仍然限制了氯氮平使用广泛。患者在服用该药物时常见的副作用包括嗜睡、细胞增多、体重增加等。此外,一些严重的不良反应如颗粒症、糖尿病、心肌炎、肠梗阻和肺炎等,也引发了临床上的关注。 氯氮平不良反应的长期认知研究 为了进一步了解氯氮平长期使用所带来的不良反应,芬兰分子医学研究所(FIMM)的研究团队基于芬兰生物样本库,开展了对氯氮平用户的长期酒精分析。
这项研究针对2600多个氯离子平用户的25年数据进行了总体分析,重点重点关注了药物使用期间的多种疾病和不良事件的发生率及其与死亡风险的关联。研究发表在《美国精神病学杂志》上,详细揭示了氯氮平长期使用的影响,特别是胃肠道运动减退、艾滋病和艾滋病等不良事件的富集。 在这项研究中,研究人员分析了包括 321,302 名参与者的数据,发现其中 3,202 人拥有氮气平的记录购买量,其中 2,659
人为精神分裂症患者。氮气平的中位使用时间为 8.4
年,而开始使用该药物后的中位患者认知时间为12.7年。研究团队通过开展的分析,确认了氯氮平使用与多种严重不良反应的关联。 五类主要不良事件的分类 根据患者在使用氮速平期间表现出的不良反应,研究人员将这些事件分为五类:胃肠道运动减退(包括肠梗阻)、肝癌、肺炎、其他急性呼吸道感染以及心动过氧化物。不良事件中的严重类型,如药物引起的中性粒细胞减少症、药物治疗和肺炎,患者需要立即接受治疗。慢性疾病方面,研究还发现了染色体平与2型糖尿病的关联。 其中,胃肠道运动减退(特别是肠梗阻)和肺炎被认为是最重要的健康风险之一。研究发现,氮平用户中肠梗阻的累计预估为5.3%,而肺炎的肺炎累计发病率为5.3%发生率则高达29.5%。这些不良事件不仅影响患者的生活质量,还显着增加了死亡风险。具体来说,肠梗阻事件使患者死亡风险增加了350%,而肺炎事件则使死亡风险增加了180%
。 性别差异与疾病富集 研究还揭示了性别与不良反应之间发生的关系。数据显示,女性患者在使用氯氮平期间更容易发生便秘、主动上呼吸道感染、损害感染以及2型糖尿病。而总体来看,69.9
% 的氯氮平用户至少经历过一种不良事件。其中,心动过速的发作率最高,共有 717 名患者经历过这种症状,其次是哥伦比亚计划(453 人)、2 型糖尿病(421
人) )和肺炎(408人)。 此外,研究还发现了氯氮平使用时间对不良事件的影响。相比于使用氯氮平前10年,开始使用氯氮平后20年,不良事件的发生率显着增加。到了50岁,氯氮平用户的肺炎、便秘、2型糖尿病、达到预期和令人激动的总发病率均超过25%。而到了70岁,几项事件的发病率甚至超过50%,其中肺炎达到69.0
%,便秘为57.2%,2型糖尿病为54.5%,血糖为73.4%,心跳加速高达76.5%。 氯氮平不良事件与死亡风险的关联 氯氮平的长期使用与患者死亡风险密切相关。研究发现,肠梗阻和肺炎是导致氯氮平用户死亡的主要不良事件。特别是,肠梗阻与患者死亡风险增加350%相关,而肺炎与死亡风险增加180%有关。另外,上一次不良事件发生到患者死亡的中位时间分别为6.8个月(肠梗阻)和1.8个月(肺炎),显示出这些不良反应对患者生命的严重威胁。 氯氮平关联基因与不良反应的关联性 为了提高细胞因子的安全性,研究人员还评估了与细胞因子发挥作用的10个基因对不良事件的影响。研究结果显示,CYP2C19和CYP1A2的活性降低与细胞因子使用期间肺炎的发生相关风险增加这表明,利用基因的差异可能是预测氯氮平不良反应的重要标志物,未来可以通过基因检测来优化患者的个体化治疗方案,减少不良反应的发生。 总结 芬兰分子医学研究所的研究通过对2600多名氯氮平用户的25年的深入研究,深入探讨了氯氮平长期使用带来的多种不良事件,特别是胃肠道运动减退(如肠梗阻)这些研究结果强调了开发预测不良反应的生物标志物和优化芯片芯片使用策略的紧迫性。未来,随着芯片芯片对芯片芯片的进一步了解,临床上通过基因检测等获得成功手段,减少不良反应,确保氯氮平在精神分裂症治疗中的安全应用。