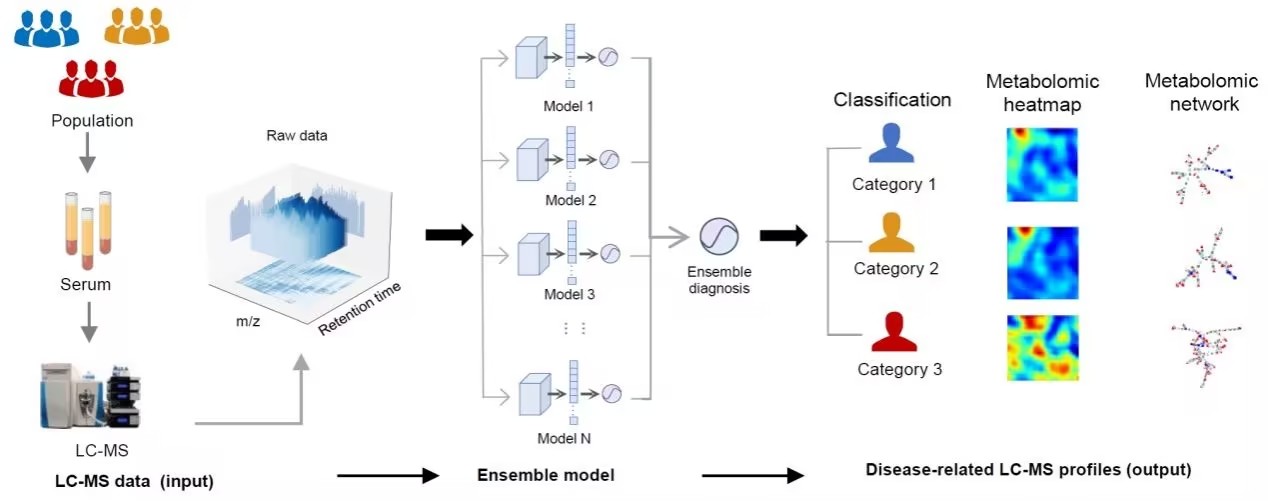
肠道是人体内负责吸收营养、产生激素和防御病原体的重要器官。其上皮组织由不同类型的特化细胞构成,其中包括一种名为簇细胞(tuft cell,
TCs)的特殊细胞。尽管对于小鼠体内簇细胞的研究已有一些进展,但人类肠道中簇细胞的确切功能仍不明确。最近,荷兰Hubrecht研究所类器官组的研究人员通过创新的类器官技术,揭示了簇细胞在肠道损伤后修复中的重要性,并展示了其作为备用干细胞的潜力。这项研究成果于2024年10月2日发表在《自然》杂志上。 簇细胞的功能与研究背景 簇细胞广泛存在于包括肠道在内的多个器官中。之前对小鼠的研究表明,簇细胞能够在感知到病原体的存在时,向免疫系统和上皮细胞发出信号,激活强烈的免疫反应,从而保护肠道免受病原体的侵害。然而,由于缺乏针对人类的研究模型,人们对簇细胞在人类肠道中的功能了解有限。 为了深入探讨簇细胞的功能,Hubrecht研究所的研究团队开发了一种类器官技术。在实验室中,他们通过类器官模型培养出与人类肠道相似的微型肠道,包含了所有类型的肠上皮细胞。第一作者Lulu
Huang指出:“这种类器官模型不仅能够让我们监测簇细胞的发育和功能,还为我们研究辐射对肠道功能的影响提供了平台。” 簇细胞作为备用干细胞的发现 此次研究的一个重要发现是,簇细胞在接收到免疫信号后能够分裂增殖。研究人员发现,当免疫系统触发簇细胞时,这些细胞可以分裂产生新的簇细胞。而这些新生成的簇细胞不仅能够继续保持簇细胞的特性,还可以通过转分化的过程生成其他类型的肠上皮细胞。这种能力表明,簇细胞在肠道损伤后能够起到修复作用,帮助受损的上皮组织恢复正常功能。 此外,研究人员还通过辐射实验,进一步确认了簇细胞的独特生存能力。在辐射损伤下,肠道中的干细胞和祖细胞常常会失去再生能力,导致肠道功能的严重受损。然而,簇细胞却能在这种极端条件下存活,并通过增殖和分化生成其他类型的上皮细胞,从而维持肠道的再生过程。 辐射损伤后的修复能力 通过实验,研究团队观察到簇细胞在辐射损伤中的关键作用。他们培养了没有簇细胞的类器官,结果显示这些类器官无法从辐射损伤中恢复。而存在簇细胞的类器官则能够在辐射后重新修复损伤的上皮组织。这一现象进一步证明了簇细胞作为备用干细胞的功能,尤其是在肠道遭受严重损伤时,簇细胞的生存能力为肠道上皮的再生提供了至关重要的支持。 组织再生中的潜在应用 这项研究不仅揭示了簇细胞在肠道修复中的作用,也为再生医学带来了新的希望。簇细胞能够在正常情况下作为一种备用干细胞库,在组织损伤时被动员并参与修复过程。研究团队成员Jochem
Bernink指出:“簇细胞在人类肠道中发挥了类似于储备干细胞的作用,它们可以在受伤时被激活,帮助组织再生。” 这一发现可能对未来的再生医学研究具有重要意义。再生医学旨在通过刺激组织的自然修复机制或利用细胞疗法修复损伤组织。研究团队的工作表明,簇细胞的存活和分化能力可能为开发新的肠道损伤治疗方案提供了有力的依据。 簇细胞在其他器官中的应用前景 除了在肠道中的作用外,簇细胞还存在于许多其他器官,如肝脏、泌尿道和肺部。研究人员对簇细胞在这些器官中的功能同样充满兴趣。未来的研究可能会揭示簇细胞在其他器官损伤修复中的作用,进一步拓展其在再生医学中的应用范围。 总之,Hubrecht研究所的类器官研究为簇细胞在肠道损伤修复中的功能提供了全新视角。簇细胞不仅能够感知病原体并激活免疫反应,还能在损伤后发挥备用干细胞的功能,修复受损的上皮组织。这一发现为未来的肠道损伤治疗以及再生医学研究提供了新的方向,也为其他器官中的簇细胞研究带来了广阔的前景。